医疗器械作为直接或间接用于人体的仪器、设备、器具,其安全性、有效性至关重要。产品技术要求是医疗器械研发、生产、检验和监管的核心文件,它详细规定了产品的性能指标、检验方法及质量保证要求。为了让相关从业者及公众更直观地理解其核心内容,以下将结合图表进行解析。
一、 技术要求的主要内容结构
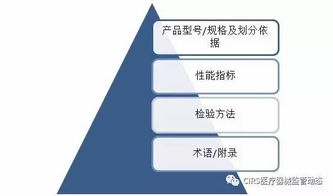
一个完整的技术要求文件通常包含以下几个核心部分,其结构关系如下图所示:
graph TD
A[医疗器械产品技术要求] --> B1[产品型号/规格及其划分说明]
A --> B2[性能指标]
A --> B3[检验方法]
A --> B4[附录(如有)]
B2 --> C1[物理性能]
B2 --> C2[化学性能]
B2 --> C3[电气安全性能]
B2 --> C4[生物性能]
B2 --> C5[软件功能]
B3 --> D1[方法原理]
B3 --> D2[仪器与试剂]
B3 --> D3[试验步骤]
B3 --> D4[结果判定]二、 核心要求详解
- 性能指标:这是技术要求的核心,必须具体、可测量。
- 物理性能:如尺寸、重量、强度、硬度、疲劳度等。例如,骨科植入物的尺寸公差、注射器的活塞滑动性能。
- 化学性能:如材料成分、重金属含量、酸碱度、残留溶剂、可沥滤物等。这对接触人体体液或组织的器械尤为重要。
- 电气安全与电磁兼容:对于有源器械,必须符合GB 9706.1(医用电气设备安全通用要求)等标准,确保防电击、防机械危险、辐射安全等,且工作时不对其他设备产生干扰,也能抵抗外界干扰。
- 生物性能:依据器械与人体接触的性质和时间,需进行细胞毒性、致敏、刺激、全身毒性等生物学评价,确保生物相容性。
- 软件功能:对于含软件的器械(如诊断设备、治疗计划系统),需明确软件的功能、运行环境、用户界面、数据接口及网络安全要求。
- 检验方法:每一项性能指标都必须有对应的、科学公认的检验方法。方法需明确到足以让不同实验室复现相同结果,通常引用国家标准(GB)、行业标准(YY)或国际标准(如ISO、IEC)。
- 型号规格划分:清晰界定同一注册单元下不同产品的区别(如不同尺寸、配置),并说明其性能指标的共性与差异。
三、 技术要求制定与监管流程
技术要求并非一成不变,其生命周期与产品研发和监管紧密相连。
graph LR
E[产品设计与研发] -- 依据预期用途与法规标准 --> F[起草技术要求草案]
F -- 内部验证与检测 --> G{指标与方法是否<br>科学、可测、可控?}
G -- 否 --> F
G -- 是 --> H[注册检验与产品定型]
H --> I[提交注册审批]
I --> J[国家药监局技术审评]
J --> K{是否批准?}
K -- 否,需补正 --> F
K -- 是 --> L[获准注册,技术要求成为法定文件]
L --> M[生产过程严格依标控制]
M --> N[上市后监管与变更管理]
N -- 产品升级/工艺变更 --> F四、 关键要点与意义
- 法规符合性:技术要求是《医疗器械监督管理条例》的法定要求,是产品注册的必备文件。
- 质量基石:它是企业组织生产、进行质量控制的根本依据,确保产品批次间的一致性。
- 监管标尺:是药品监督管理部门开展上市后监督抽检、不良事件调查的判断基准。
- 动态发展:随着科技进步、标准更新或临床反馈,技术要求可通过变更注册进行修订和完善。
医疗器械产品技术要求是将法规、标准、科学与具体产品相结合的结晶。通过清晰的图表化解读,可以帮助研发人员精准设计,生产者规范制造,监管者有效监督,最终共同守护公众用械安全。