医疗器械行业对产品的安全和有效性要求极高,厂商需严格遵循法规和标准。以下通过3个关键流程图,帮助医疗器械厂商清晰梳理工作须知。
一、产品研发与注册流程图
1. 需求分析:明确临床需求与市场定位。
2. 设计开发:进行概念设计、详细设计、原型制作。
3. 验证与确认:包括实验室测试、动物实验(如适用)、临床评价。
4. 注册申报:准备技术文档,提交国家药品监督管理局(NMPA)审批。
5. 取得注册证:通过审核后获得产品上市许可。
说明:整个过程需遵循质量管理体系(如ISO 13485),确保数据真实完整。
二、生产质量管理流程图
1. 原材料采购:选择合格供应商,进行进货检验。
2. 生产过程控制:依工艺规程操作,实施过程检验。
3. 成品检验:按标准进行全项目检测,合格后放行。
4. 储存与运输:确保环境条件符合产品要求。
5. 追溯管理:建立唯一标识(UDI)系统,实现全生命周期可追溯。
说明:厂商需建立并维护质量管理体系,定期接受飞行检查和体系考核。
三、上市后监督与维护流程图
1. 不良事件监测:收集、评估和报告产品相关不良事件。
2. 售后服务:提供技术支持和培训,处理客户投诉。
3. 定期评估:进行产品风险再评价和临床跟踪。
4. 变更管理:如有设计、工艺等变更,需重新评估并报备。
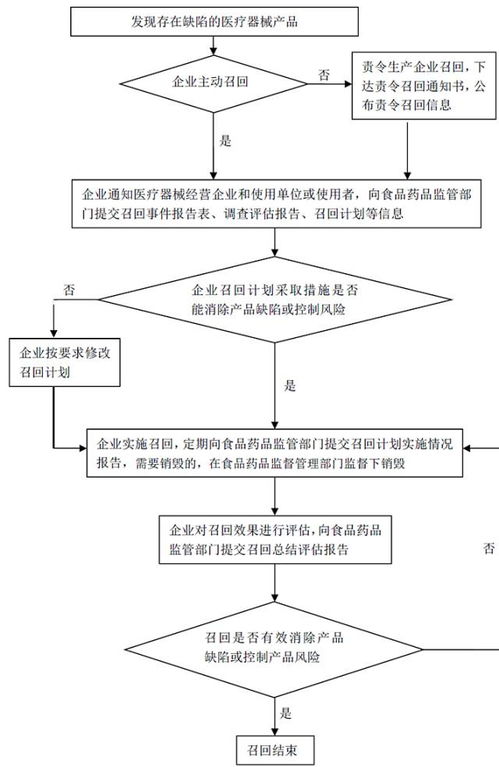
5. 产品召回:发现问题时及时启动召回程序。
说明:上市后监督是法规强制要求,厂商应建立主动监测体系,保障患者安全。
医疗器械厂商需以法规为准绳,以质量为核心,通过系统化流程确保产品安全有效,并承担全生命周期责任。建议厂商结合自身产品特点,细化流程,加强人员培训,以提升合规性和市场竞争力。